Definition
CMV infection
증상의 유무와 관계없이 CMV 복제가 존재하는 상태를 의미합니다. CMV 복제는 (1) 핵산 증폭 검사(NAT), (2) 항원 검사, (3) 배양 검사 등을 통해 확인됩니다. 사용된 검사 방법에 따라 CMV 감염은 CMV DNAemia 또는 RNAemia(NAT 기반), CMV antigenemia(바이러스 항원 검사 기반), CMV viremia(배양 기반)로 분류될 수 있습니다.
CMV disease
임상적 징후 및 증상을 동반하는 CMV 감염을 의미합니다. CMV 질환은 다음 두 가지로 분류됩니다. (1) CMV 증후군: 발열 및/또는 권태감, 백혈구 감소증 또는 혈소판 감소증을 특징으로 합니다. (2) 조직 침윤성 CMV 질환: 위장관 질환, 폐렴, 간염, 신염, 심근염, 췌장염, 망막염 등 다양한 장기 침범을 포함합니다.
임상적인 증상이 동반되지 않은 CMV 감염은 “무증상 CMV 감염(asymptomatic CMV infection)”으로 명시되어야 합니다.
Risk Factors of CMV disease
(1) 일차 CMV 감염은 이식 전 CMV에 대한 면역이 형성되지 않은 장기이식(SOT) 수혜자에서 발생합니다. 대표적인 예로는 공여자가 CMV 혈청 양성이며 수혜자가 혈청 음성인 경우(D+R–)입니다.
(2) CMV 질환의 위험은 전체적인 면역억제 상태에 따라 달라집니다. 이는 면역억제 요법의 종류, 용량, 시기 및 지속기간 같은 면역억제 프로토콜뿐 아니라, 연령, 동반질환, 백혈구 감소증 및 림프구 감소증, 유전적 요인 등의 숙주 요인, 냉장 허혈 시간, 중증 질환, 스트레스 등의 기타 요소에 의해 결정됩니다.
(3) 항림프구 항체와 같은 림프구 고갈 제제의 사용은 특히 거부 반응 치료에 사용될 때 CMV 질환 발생과 관련이 있습니다.
(4) 폐 및 소장 이식 수혜자는 SOT 수혜자 중에서도 CMV 질환의 위험이 가장 높은 집단으로 간주됩니다. 이는 이식된 장기에 포함된 림프 조직의 양과 면역억제 강도 때문입니다.
(5) 인간 헤르페스바이러스(HHV)-6 및 HHV-7과의 동시 감염은 CMV 질환의 위험 요인으로 제안된 바 있습니다.
CMV 공여자 음성/수혜자 음성(D–/R–)인 장기이식 수혜자는 CMV 질환의 위험이 가장 낮으며, 이들은 CMV 음성 혈액 또는 백혈구 제거 혈액 제제를 받아야 합니다. mTOR 억제제(에베롤리무스, 시롤리무스)의 사용은 CMV 질환의 위험을 낮추는 것으로 알려져 있습니다.
Laboratory Diagnosis
(1) histopathology
조직침윤형 CMV 질환의 존재를 확인하는 데 사용되며, 진단을 위해 침습적인 방식으로 조직을 채취해야 합니다. 혈액 내 CMV 검사 결과가 음성이지만 위장관 CMV 질환 등 특정 상황에서 CMV 질환이 의심될 경우 조직병리검사가 필요할 수 있습니다.
(2) culture
바이러스 배양은 CMV 감염 진단에 있어 특이도가 매우 높은 방법입니다. 그러나 민감도가 낮고 결과 도출까지 시간이 오래 걸리는 단점이 있어 사용에 제한이 있습니다. 조직 배양의 경우, 바이러스 검출까지 수 주가 소요될 수 있습니다. 항바이러스제에 대한 표현형 약제 내성 검사를 시행할 경우 바이러스 배양이 필요하지만, 약제 내성 검출에는 일반적으로 유전자형 분석이 더 선호되는 방법입니다.
(3) serology
CMV-IgM 및 IgG 항체를 검출하는 혈청학적 검사는 이식 후 CMV 질환 진단에 있어 유용성이 제한적입니다. 면역억제 상태에 있는 장기이식 수혜자는 CMV 감염에 대한 항체 반응이 지연되거나 불완전할 수 있기 때문입니다. 따라서 CMV-IgM 및 IgG 항체를 검출하는 혈청 검사는 CMV 질환 진단에 사용되어서는 안 됩니다.
(4) antigenemia
CMV에 감염된 말초혈액 백혈구 내 pp65 항원을 검출하는 반정량적 검사입니다. 이 검사는 선제적 치료를 위한 판단, 빠르고 민감한 CMV 질환 진단, 치료 반응 평가 등에 유용합니다. 그러나 검사 시료를 몇 시간 내에 처리해야 한다는 제한점이 있으며, 백혈구 수에 의존하는 검사이기 때문에 백혈구 감소증 환자에서는 유용성이 떨어집니다.
(5) molecular assays that detect and quantify CMV nucleic acid (NAT)
CMV DNA 또는 RNA를 검출하는 분자진단 검사는 장기이식 후 CMV 진단에 있어 선호되는 방법입니다. CMV RNA의 검출은 활성 CMV 복제를 의미합니다. 반면, CMV DNA의 검출은 활성 복제를 반드시 의미하지는 않는데, 그 이유는 민감도가 매우 높은 핵산 증폭 검사(NAT)를 사용하면 잠복 바이러스의 DNA까지 증폭될 수 있기 때문입니다. 이에 따라 활성 바이러스 복제(일반적으로 높은 바이러스 부하와 관련됨)와 잠복 감염(고감도 검사에서 낮은 수준의 CMV DNA혈증으로 나타남)을 구분하기 위해 정량 핵산 증폭 검사(QNAT)가 개발되었습니다.
일반적으로 높은 CMV 바이러스 부하는 조직침윤형 질환과 관련이 있으며, 낮은 수치는 무증상 CMV 감염과, 중간 정도의 수치는 CMV 증후군과 관련이 있습니다. 또한 CMV 부하가 빠르게 증가할수록 CMV 질환의 위험도 높아집니다.
QNAT는 선제적 치료를 위한 판단, CMV 감염의 빠르고 민감한 진단, 치료 반응 평가에 유용합니다.
QNAT의 주요한 한계는 최근까지 국제 표준 기준이 존재하지 않았다는 점입니다. 이에 따라 한 검사에서 얻은 바이러스 부하 수치를 다른 검사 결과와 동일하게 해석할 수 없습니다. 다양한 검사 플랫폼, 검체 유형, 표준물질, 유전자 표적, 추출 기술 등의 차이로 인해 서로 다른 CMV QNAT 검사 간 최대 3 log10 수준의 차이가 보고된 바 있습니다.
2011년, WHO는 CMV 핵산 정량을 위한 최초의 국제 표준 기준을 발표하였으며, 현재는 모든 실험실 및 상업적으로 개발된 CMV QNAT 검사들이 이 기준에 맞춰 교정되어야 합니다.
CMV QNAT 또는 pp65 항원혈증 검사는 항바이러스 치료에 대한 CMV 질환의 반응을 모니터링하기 위해 주 1회 시행해야 하며, 선제적 치료를 통한 예방이 사용되는 경우 CMV 질환 발생 위험 예측을 위해서도 주 1회 시행해야 합니다.
Prevention of CMV Disease
The two major strategies for CMV prevention
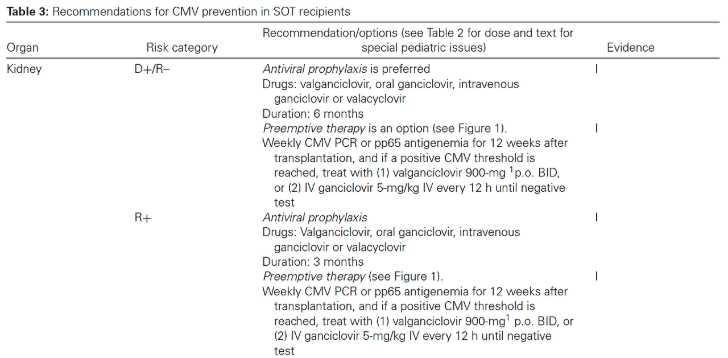
(1) Antiviral prophylaxis (Universal Anti-CMV Prophylaxis)
항바이러스제 예방요법이란, 장기이식 후 일정 기간 동안 모든 “위험군” 환자에게 항바이러스제를 투여하는 것입니다. 이 접근법은 다른 헤르페스바이러스의 재활성화도 예방할 수 있는 이점이 있으며, CMV의 간접적인 영향 발생률을 낮추는 것과도 관련이 있습니다.
그러나 항바이러스제 예방요법은 특히 CMV D+/R– 환자에서 늦게 발현되는 CMV 질환(late-onset CMV disease)과 관련이 있습니다.
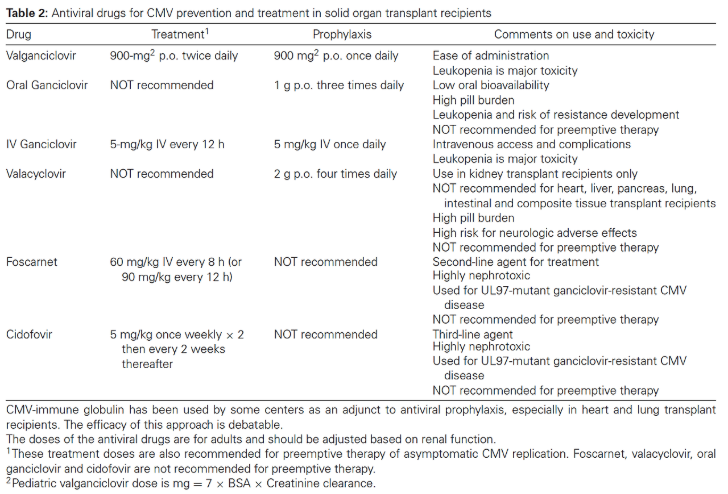
CMV 예방을 위한 항바이러스제로는 발간시클로비르(valganciclovir)와 경구 또는 정맥용 간시클로비르(ganciclovir)가 사용됩니다. 일반적으로 항바이러스제 예방요법은 가능한 한 조기에, 이식 후 첫 10일 이내에 시작하는 것이 바람직합니다.
한편, CMV D–/R– 장기이식 수혜자에게는 CMV 음성 혈액 또는 백혈구 제거 혈액 제제를 제공받는 한, CMV 특이적 항바이러스제 예방요법은 권장되지 않습니다.
(2) Preemptive therapy (Pre-Emptive Anti-CMV Therapy)
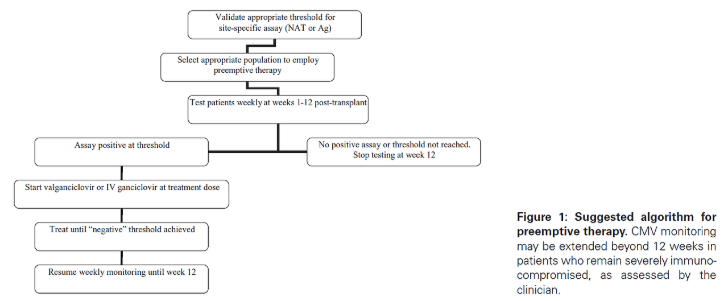
선제적 치료란, 증상이 없는 환자 중 CMV의 초기 증식 증거가 있는 경우에만 항바이러스제를 투여하여 질환으로의 진행을 예방하는 전략입니다. 장기이식 수혜자는 CMV QNAT 또는 pp65 항원혈증 검사와 같은 실험실 검사법을 이용하여 일반적으로 주 1회 정기적으로 초기 CMV 증식 여부를 모니터링하게 됩니다.
이 전략은 약물 비용과 부작용을 줄일 수 있다는 장점이 있으나, 이식 센터로부터 거리가 먼 환자에게는 적용이 어려운 단점이 있습니다. 또한, QNAT의 표준화 부족으로 인해 현재는 선제적 치료를 시작하기 위한 널리 수용 가능한 바이러스 역치(viral load threshold)가 존재하지 않는 상황입니다.
현재까지도 모니터링 방법(pp65 항원혈증 또는 QNAT), 항바이러스 치료를 시작할 바이러스 역치, 치료의 지속 기간, 실험실 모니터링의 지속 기간 등에 대해서는 명확한 합의가 이루어지지 않았습니다. 이러한 이유로, 각 기관에서는 선제적 치료를 시행하기 전, 사용하는 검사법과 상황에 따라 해당 기관에 맞는 바이러스 역치를 검증하고 설정하는 것이 필요합니다.
권장되는 모니터링 빈도는 이식 후 12주 동안 주 1회입니다. 만약 pp65 항원혈증 검사 또는 QNAT에서 정해진 역치 이상으로 양성 결과가 나타난 경우에는, 경구용 발간시클로비르(1일 2회 900mg) 또는 정맥용 간시클로비르(1일 2회 5mg/kg)로 치료를 시작해야 합니다.
항바이러스 치료는 CMV DNA혈증 또는 항원혈증이 더 이상 검출되지 않을 때까지 지속해야 합니다. 많은 전문가들은 주 1회 검사에서 2주 연속 음성 결과가 나올 때까지 치료를 유지할 것을 권장하고 있습니다. 항바이러스 치료 중에도 QNAT 또는 pp65 항원혈증 검사를 주 1회 시행하여 모니터링하는 것이 바람직합니다.
두 가지 치료에 대한 비교 연구
두 가지 치료 전략(선제적 치료 vs. 항바이러스 예방요법)에 대한 비교 연구는 많지 않으며, 대부분 신장이식 수혜자를 대상으로 한 소수의 무작위 임상시험에서 이루어졌습니다.
이러한 연구들은 두 방법 모두 CMV 질환 예방에 있어 유사한 효과를 보인다는 점을 시사하였습니다.
그러나 장기적인 이식 장기(graft)의 생존율은 항바이러스 예방요법을 시행한 군에서 유의하게 더 높게 나타났습니다.

* Preemptive therapy 의 치료 알고리즘
Treatment of CMV Disease
CMV 질환 치료에 사용되는 항바이러스 약물은 정맥용 간시클로버(ganciclovir)와 경구용 발간시클로버(valganciclovir)입니다. 정맥용 간시클로버는 5 mg/kg을 12시간마다, 경구용 발간시클로버는 900 mg을 하루 두 번 투여합니다.
경구용 간시클로버는 생체이용률이 낮아 치료에 필요한 전신 약물 농도를 충분히 확보할 수 없기 때문에 CMV 질환 치료에 사용해서는 안 됩니다. 이로 인해 치료 실패뿐만 아니라 간시클로버 내성의 발생 위험도 높아질 수 있습니다.
항바이러스 치료의 기간은 환자의 임상 증상 해소와 바이러스학적 소실을 기준으로 개별적으로 조정해야 합니다. 일반적으로 장기이식 수혜자에서 CMV 질환이 확인된 경우, 치료 반응을 평가하기 위해 pp65 항원혈증 검사 또는 CMV 정량핵산증폭검사(QNAT)를 주 1회 시행하여 바이러스 반응을 모니터링해야 합니다.
따라서 CMV 질환 환자는 바이러스가 검출되지 않거나 검사에서 음성 기준치 이하로 떨어질 때까지, 항바이러스제를 완전 치료 용량으로 지속 투여해야 합니다.
* CMV 치료의 목표
Treatment of CMV disease should be continued until the following criteria are met :
–> 모두 and 관계
CMV 질환의 치료 종료 기준은 다음 세 가지를 모두 충족해야 합니다:
- 임상 증상의 호전 (Resolution of clinical symptoms)
→ 발열, 피로감, 혈액학적 이상 등 질환에 따른 주요 증상이 해소되어야 합니다. - 바이러스 소실 (Virologic clearance)
→ CMV 정량 핵산증폭검사(CMV QNAT) 또는 pp65 항원혈증(pp65 antigenemia)을 이용한 주 1회 실험실 모니터링에서, 검사별 음성 기준치 이하로 바이러스 수치가 감소해야 합니다. - 최소 2주 이상의 항바이러스 치료 기간
→ 임상 및 바이러스 반응이 좋더라도 최소 2주간 항바이러스 치료를 유지해야 합니다.
또한, 정맥용 간시클로버(ganciclovir)로 초기 치료를 시작한 이식 환자의 경우, 임상적·바이러스학적 조절이 충분히 이루어진 뒤에는 경구용 발간시클로버(valganciclovir)로 전환할 수 있습니다.
→ 이는 입원 치료 부담을 줄이고 외래 치료로 전환 가능하게 해주는 중요한 전략입니다.
Ganciclovir Resistant CMV
간시클로버의 초기 인산화는 CMV 유전자 UL97이 암호화하는 키나아제에 의해 이루어집니다. 이후 세포 내 효소들에 의해 추가 인산화가 진행되어 활성형인 간시클로버-삼인산(ganciclovir-triphosphate)으로 전환되며, 이 물질은 바이러스 유전자 UL54가 암호화하는 CMV DNA 중합효소를 경쟁적으로 억제합니다. 따라서 UL97 유전자 돌연변이와 드물게 UL54 유전자 돌연변이가 간시클로버 내성을 일으킬 수 있습니다.
UL97과 UL54의 복합 돌연변이는 보통 높은 수준의 간시클로버 내성을 보이지만, UL97 돌연변이가 없는 상태에서 단독으로 UL54 돌연변이가 발생하는 경우는 드뭅니다.
UL97 돌연변이가 있는 간시클로버 내성 CMV 치료에는 대개 포스카르넷(foscarnet)이 1차 치료제로 사용됩니다. 그러나 이 약물은 이식 환자에게서 심각한 신독성을 유발할 수 있다는 점이 주요 문제입니다.
시도포비르(cidofovir)도 대체 치료제로 사용되나, 이 역시 신독성이 매우 강합니다. 일반적으로 UL97 돌연변이를 가진 간시클로버 내성 CMV는 포스카르넷과 시도포비르에 대해 감수성을 유지합니다.
간시클로버, 포스카르넷, 시도포비르는 모두 UL54가 암호화하는 CMV DNA 중합효소를 경쟁적으로 억제하는 기전을 가지므로, UL54 유전자 돌연변이 위치에 따라 이들 약물에 대한 내성이 발생할 수 있습니다. 따라서 치료 결정은 유전자형 검사 결과를 바탕으로 이루어져야 합니다.
간시클로버 내성 CMV의 발생률은 비교적 낮은 편입니다. 3개월간 경구 간시클로버 예방요법을 받은 장기이식 환자에서는 약 1.9%에서 내성이 보고되었고, 3개월간 발간시클로버 예방요법을 받은 환자에서는 내성이 발견되지 않았습니다. 내성 위험인자로는 장기간 저용량 경구 예방요법, D+/R– 혈청 상태, 면역억제 강도 증가, 폐 이식 등이 알려져 있습니다.
* Gaciclovir 내성을 의심해야 하는 상황
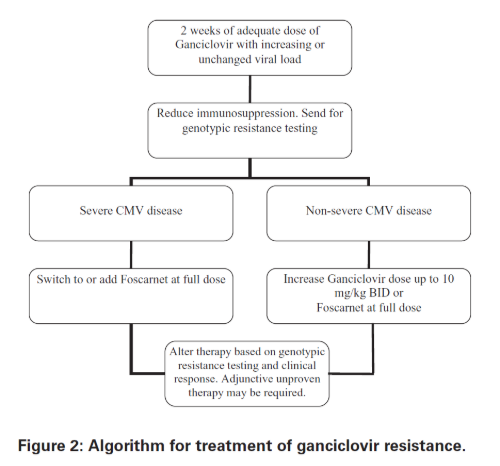
내성은 다음과 같은 경우에 의심해야 합니다. 첫째, 환자가 항바이러스 예방요법이나 선제적 치료로 장기간 항바이러스제를 복용한 경우, 둘째, 2주간 적절한 용량의 항바이러스 치료에도 불구하고 바이러스 부하가 감소하지 않거나 오히려 증가하는 경우, 셋째, 환자가 내성 위험 인자를 가지고 있는 경우입니다.
내성 CMV 관리를 위해서는 유전적 내성 검사(genotypic resistance testing)가 매우 도움이 되며, 표현형 내성 검사(phenotypic resistance testing)보다 유전형 검사가 선호됩니다.
내성 CMV 질환이 있는 환자에서는 면역억제제를 신중하게 감량하는 것이 필요합니다. 특히 mTOR 억제제를 포함한 치료법으로 전환하는 것이 하나의 선택지가 될 수 있는데, 이는 mTOR 억제제를 사용하는 환자에서 CMV 질환 위험이 낮게 보고되었기 때문입니다.
내성 CMV 질환의 경험적 치료 옵션으로는 정맥용 간시클로버의 용량을 1일 2회 최대 10 mg/kg까지 증가시키거나, 정규 용량의 포스카르넷을 사용하는 방법이 있습니다.
Reference :
The AST Infectious Diseases Community of Practice.
The American Society of Transplantation Infectious Disease Guidelines 3rd Edition. Am J Transplant 2013;13