Introduction
Second primary tumors
– ‘Synchronous’ : Detected or resected simultaneously
– ‘Metachronous’ : Detected some time after the primary lesion
Incidence of synchronous lung cancers
– ranges from 0.2% to 8% (3.5%-14% in autopsy studies)
– Around 900,000 new multiple cancer cases globally (8% of 10,900,000)
– Age 50-64 : 5~12% / Age >80 : 12~26%
Second primary tumor 에 대해 2가지 방법으로 표현이 가능합니다. Synchronous 는 동시에 발견된 것을 말하며, Metachronous 는 한병변이 생기고 난 뒤 일정시간이 지난 후 새로운 병변이 생겼을 때를 말합니다.
Synchronous lung cancer 는 전체 lung cancer 환자의 0.2~8% 정도 발생한다고 보고되고 있으며, 세계적으로 매년 90만명의 사람들이 새로운 multiple cancer 가 발생한다고 알려져 있습니다.
Single institution’s 28-year experience (Antakli et al. 1995)
– 1572 curative resections.
– 54 (3.4%) have 65 second primary lesions
– 39 (60%) metachronous / 26 (40%) synchronous
– Occurred between 5 ~ 218 months after initial curative resection
– The time btw. 2nd and 3rd primary tumor was much shorter (5.5~51 mo.)
– 50% of 2nd primary tumors : similar histological type to 1st.
1995년 한 기관에서 28년간의 데이터를 토대로 작성한 통계에서는 1572건의 수술 케이스에서 65건의 second primary cancer 가 발견되었으며, 그 중 60%는 metachronous, 나머지 40%는 synchronous lesion 이었고, Metachronous cancer는 Surgery 이 후 5~218 개월 후 발생하였으며, 3rd primary cancer 의 경우에는 그보다 더 짧은 5.5~51 개월 뒤 발생하였습니다. 50% 정도는 서로 조직학적으로 유사하였습니다.
Frequency of recorded synchronous or metachronous lung cancers
– has been increasing in the recent years
– development of early detection techniques : CT and PET
– advances in cancer therapy, resulting in a longer period of patient survival.
Diagnosis of a second primary lung cancer is complex.
– Difficulties in differentiating between ‘metastatic’ VS ‘primary lesions’ if…
–> Occurs within 2 years of the initial tumor
–> Similar histological subtype
–> Located in area of previous RTx.
–> changes tissue morphology.
최근 들어 이러한 multiple primary lung cancer 발생이 증가하는데, 그것은 CT나 PET 등 진단 검사 기기의 발전, 그리고 암치료의 발전으로 암환자의 생존 기간이 증가했기 때문일 것으로 생각됩니다.
하지만 second primary lung cancer의 진단은 매우 복잡합니다. 즉, meta 인지 구별하기가 어려울 수 있습니다. 특히 처음 cancer 가 발병한지 2년 이내에 새로운 병변이 생겼을 경우나, 조직학적으로 유사한 경우, 또는 RT 받았던 곳에서 새롭게 병변이 발생했을 경우 구분하기 어렵습니다.
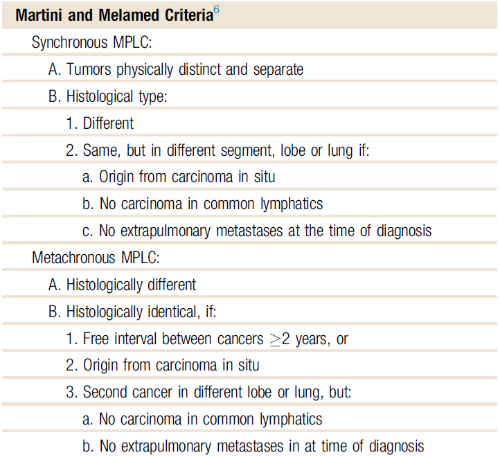
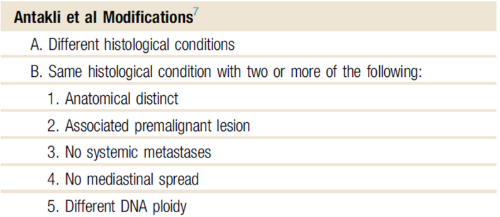
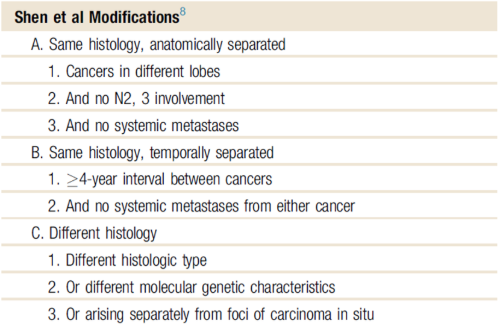
따라서 여러가지 진단 기준들이 제시되고 있는데, 가장 널리 알려진 것이 Martini 의 criteria 입니다.
Pathogenesis
“Field cancerization” process (Slaughter et al, 1953)
“Field cancerization”이라는 개념은 1953년 Slaughter 등이 처음 제안한 것으로, 다음과 같은 특징을 가집니다. 흡연과 관련된 발암 물질의 자극은 기관지 나무(bronchial tree)의 다양한 감수성 있는 세포들에 영향을 주어, 침습성 폐암이 동시에 혹은 연속적으로 발생할 수 있는 환경을 조성합니다. 이러한 발암성 노출 또는 유전적 요인은 특정 조직이나 장기에 영향을 미쳐, 동일한 부위 내의 여러 세포들이 암으로 변형될 수 있는 가능성을 증가시킵니다. 그 결과, 서로 다른 클론(clone)의 세포 집단들이 독립적인 유전적 변화를 축적하게 됩니다. 이는 같은 기관 내에서 유전적으로 다른 여러 종양이 발생할 수 있음을 의미합니다.
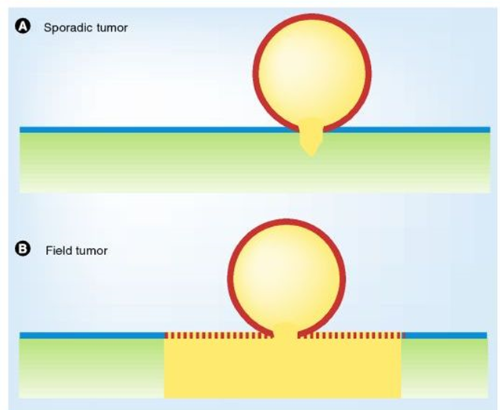
Field cancerization 는 조직 내에서 암이 발생하는 방식의 차이를 설명하는 개념으로, 두 가지 모델로 나눌 수 있습니다:
(A) Field cancerization 없이 발생하는 종양 형성
국소적인 점막(mucosa) 영역에서 종양 유발 돌연변이가 발생하고, 이로 인해 병변이 자라게 됩니다. 이 과정에서 암세포 주변의 간질(stroma) 조직에서도 변화가 일어날 수 있지만, 이러한 변화는 종양을 둘러싼 작은 영역에 국한됩니다. 다시 말해, 종양은 특정한 부위에서만 발생하고 그 주변 조직은 대부분 정상 상태를 유지합니다.
(B) Field cancerization에 의한 종양 형성
종양 성장을 유발할 가능성이 있는 돌연변이 클론이 점막 전반에 걸쳐 퍼지게 됩니다. 이후 추가적인 유전적 변화가 누적되면서, 이 클론 중 일부가 종양으로 발전하게 됩니다. 이 경우, 점막 전체가 이미 돌연변이된 상태이며, 하나 이상의 위치에서 종양이 발생할 수 있습니다. 이러한 돌연변이 클론은 간질 조직의 반복적인 활성화(예: 만성 염증이나 흡연 등 환경 요인)에 의해 유도되었을 수도 있습니다.
색상 설명 (도식에 따른 색상 코드):
- 초록색: 정상 간질
- 노란색: 활성화된(종양 유발성) 간질
- 파란색: 정상(야생형) 상피세포
- 붉은색 점선: 돌연변이가 생겼지만 아직 종양은 아닌 상피세포
- 붉은색 실선: 종양 상피세포
이 모델은 흡연 등 반복적인 발암 인자가 점막 전반에 영향을 주어, 한 부위가 아닌 넓은 영역에서 암이 발생할 수 있음을 설명합니다.
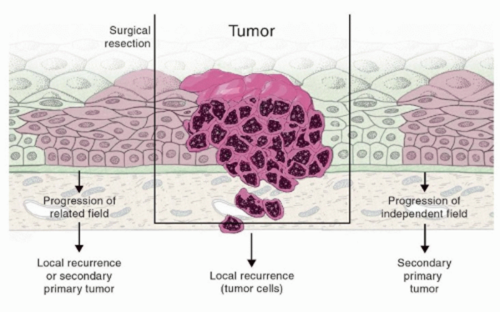
Field cancerization 는 하나 이상의 점막 부위에 암과 연관된 유전적 또는 후생유전적 변화가 축적된 상피세포들이 존재하는 현상을 말합니다.
이러한 변화가 일어난 점막 영역을 preneoplastic field 라고 하며, 이는 일반적으로 단일 클론(monoclonal)에서 유래합니다. 즉, 하나의 유전적으로 변화된 세포가 증식하면서 해당 필드를 형성합니다. 이 전암성 필드는 침습적 성장이나 전이와 같은 악성 종양의 특징을 보이지 않으며, 따라서 아직 침습성 암으로 발전한 상태는 아닙니다.
하지만 이 필드 내의 세포들은 이미 암으로 진행될 가능성이 높은 상태이며, 이론적으로 한 환자에게 다수의 원발암(multiple primary tumors)이 생길 수 있는 근거를 제공합니다. 실제로 분자생물학적 분석 결과를 통해 Field cancerization 개념이 지지되고 있습니다.
요약하면, Field cancerization는 암 발생 전 단계에서 이미 특정 조직이 넓은 영역에 걸쳐 변화되어 있다는 개념으로, 암의 재발이나 다발성 원발암의 발생을 설명하는 데 중요한 이론적 기반이 됩니다.
Cancer recurrence
–> Represents “treatment failure”
Development of new primary tumor
–> Suggestive of “persistent exposure to etiological risk factors”
Smoking cessation
– Reduce the relative risk of development of a second primary lung cancer in patients who have received a curative-intent therapy.
즉 cancer의 재발이 치료의 실패를 뜻한다면, 새로운 primary cancer 가 생겼다는 것은 원인이 되는 위험인자의 노출이 지속되어 왔다는 것을 뜻합니다. 즉 curative 목적의 수술을 받은 lung cancer 환자에게서 적극적으로 금연하도록 이끌어 Second primary lung cancer 발생 위험을 줄여야 합니다.
Genetic marker for clonality analysis
– p53, K-ras, EGFR
– Inactivation of X-chromosome
– Loss of heterozygosity
– No statistically significant association was observed between tumor clonality and patient survival.
또한 p53, K-ras, EGFR 등의 genetic marker 에 대한 연구도 이루어 지고 있으나, 아직 multiple primary lung cancer 진단 기준에 제시되어 있지 않습니다.
Management
Synchronous primary lung cancers
– 2 tumors should be staged separately
– Managed as distinct tumors.
Surgery
– regarded as the treatment of choice
– clinical stage of the second tumor
– cardiopulmonary reserves of the patient
Synchronous primary lung cancer 는 2개 tumor 를 각각 따로 staging 해야하고, 치료도 따로 구분되어 생각해야합니다. 그 중 treatment of choice 는 surgery 입니다. Op. 를 위해서는 각 cancer 의 stage 도 중요하지만, 2개의 cancer 에 대해 수술 해야하므로, 그 환자의 cardiopulmonary reserve 도 중요합니다.
Anatomical resection of the second tumor
– First choice for surgery : mono- or bilobectomy
– Followed by sublobar resections ; segmentectomy, wedge resection
– Anatomical resection of 1st tumor + subsequent sublobar resection
Anatomical resection 을 위한 수술 방식은 lobectomy 가 first choice 가 되나, Segmentectomy 나 wedge resection 같은 sublobar resection 을 시행하기도 합니다.
어떤 문헌에서는 크기가 큰 첫번째 cancer 를 lobectomy 로 절제하고, 나머지 작은 cancer 를 sublobar resection 으로 수술하는 방법이 주된 수술 방법으로 소개하고 있습니다.
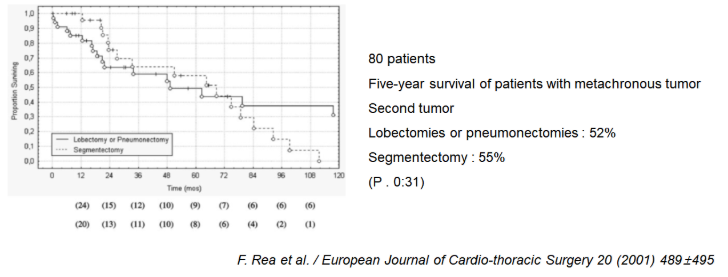
2001년에 80명의 수술 환자를 대상으로 한 연구에서는, Second tumor 에 대해 lobectomy 혹은 pneumonectomy 를 시행한 군과, segmentectomy 만 시행한 군에서 5년 생존률이 각각 52%, 55%로 유의미한 차이를 보이지 않았습니다.
SBRT (Stereotactic body radiation therapy)
Reported similar outcomes after SBRT and surgical Tx. for early stage NSCLC (T1a/T1b)
수술 외의 또다른 치료 방법으로 SBRT 가 있겠습니다. 특히 NSCLC stage T1a 나 T1b 의 early stage 의 경우 수술적 치료 방법과 치료 효과가 비슷하다고 보고 되었습니다.
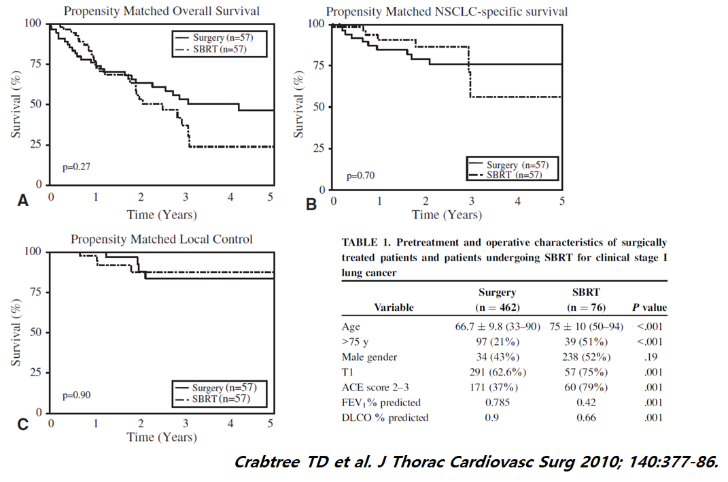
Clinical stage I 인 NSCLCa 환자에서 overall survival 및 국소 재발에 있어 수술과 SBRT 는 서로 큰 차이를 보이지 않았습니다.
또 다른 연구에서도 Clinical stage I 인 NSCLCa 환자에서 Lobectomy, sublobar resection, SBRT의 경우 서로 유의미한 차이는 없었습니다.
Feasibility, safety, efficacy
Considered a standard of care for patients with resectable, but medically inoperable lung cancer.
즉 SBRT는 적용하기 비교적 쉽고, 안전하며, 효과적인 치료 방법으로, 그 병변이 resectable 하나 고령이나 comorbidity 로 인한 수술이 불가능한 lung cancer 의 환자에서 고려되어야 할 방법입니다.
Prognosis
5-year survival rates after resection of metachronous malignancy : 20~65%
Early stage (stage I and II) of second tumor : better prognosis
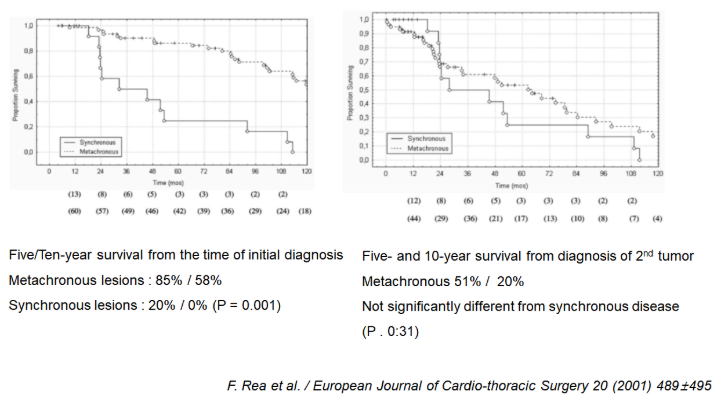
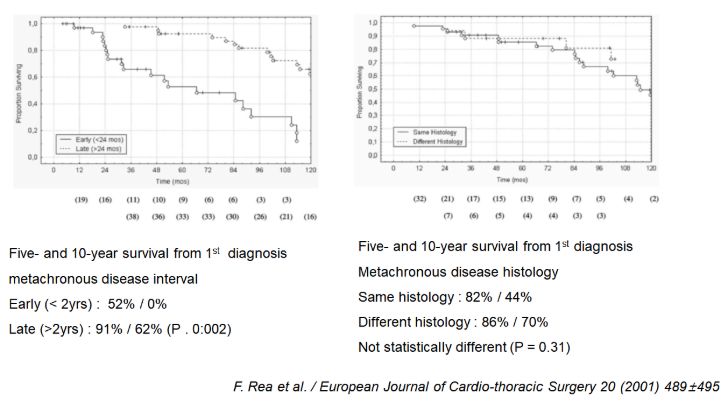
F. Rea et al. 2001.
– From 1971 to 1999, 80 patients
– Division of Thoracic Surgery of the University of Padua. Italy
– Synchronous tumors : 19 patients (23.5%)
– Metachronous tumors : 61 patients (76.5%).
Reference :
Angeliki A. Loukeri et al. Clinical lung cancer 16 (2015) No.1 15-23
F. Rea et al. / European Journal of Cardio-thoracic Surgery 20 (2001) 489±495
Varlotto JM et al. Cancer 2013; 119: 2683-91.
Crabtree TD et al. J Thorac Cardiovasc Surg 2010; 140:377-86.
A. S. Wallace, Thoracic Cancer ISSN 1759-7706