CMV Infection (CMV 감염)
Human cytomegalovirus (HCMV)는 betaherpesvirus에 속합니다. HCMV (Human CMV)는 인간herpesvirus 군에서 가장 큰 바이러스이며, 인간에게 감염되는 바이러스 중 가장 큰 것으로 알려져 있습니다. CMV의 유전체는 236 kbp 길이의 선형 이중 가닥 DNA(double-stranded DNA) 분자입니다. CMV double-stranded DNA는 nucleoprotein core에 감싸여 있으며, 이 코어는 matrix protein과 CMV의 pp65 antigen으로 둘러싸여 있습니다. 이러한 matrix와 내부 코어를 감싸고 있는 lipid envelope에는 바이러스가 세포에 침입할 때 관여하는 viral glycoprotein이 포함되어 있습니다.
CMV 감염은 전 세계 모든 인구 집단에서 흔하게 나타나며, 미국 도시에서는 60~70%, 아프리카 일부 지역에서는 거의 100%의 감염률을 보입니다. Cytomegalovirus (CMV)에 감염된 사람에서 나타나는 질병의 양상은 다양합니다. 건강한 사람에서는 증상이 전혀 없을 수 있는 반면, 신생아에서는 congenital CMV syndrome이 발생할 수 있으며, 이 경우 치명적인 경과를 보이는 경우도 많습니다. 청년층에서는 infectious mononucleosis syndrome이 나타날 수 있습니다.
특히 면역억제(immunocompromise) 상태의 환자에서는 CMV가 폐, 간, 신장, 심장 이식 환자에게 가장 중대한 질병 증후군을 유발합니다. Polymorphonuclear cells, T lymphocytes, endothelial vascular tissue, renal epithelial cells, salivary glands 등은 바이러스를 비활성 상태(nonreplicating) 또는 느리게 증식하는 형태(slowly replicating form)로 보유할 수 있습니다. 이러한 잠복(latent) 상태는 면역억제, 다른 질환, 또는 항암제(chemotherapeutic agents) 사용 이후 활성화될 수 있습니다.
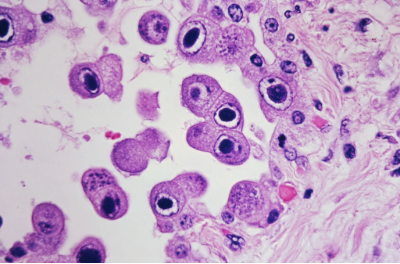
CMV의 다양한 strain(변종)은 species specific(종 특이성)을 가지며, cytopathic effect(세포병변 효과)를 유발하여 세포가 현저히 커지는 cytomegalic cell(거대세포)을 형성하고, 이들 세포 내에는 cytoplasmic 및 intranuclear inclusions(세포질 및 핵 내 봉입체)가 관찰됩니다.
Primary infection(일차 감염)은 CMV에 대해 seronegative(혈청 음성)이며 이전에 감염된 적이 없는 환자에서 발생합니다. 반면, secondary infection(이차 감염)은 잠복해 있던 감염의 재활성화이거나 seropositive(혈청 양성) 상태에서의 재감염을 의미합니다. 임상적으로 나타나는 CMV 질환은 primary와 secondary infection 모두에서 발생할 수 있으며, 일반적으로 primary infection에서는 바이러스 복제 수준이 더 높고 질병의 중증도도 더 심한 경향이 있습니다.
HCMV genome은 하나의 origin of replication(복제 개시점)을 포함하고 있으며, 모든 human herpesvirus와 마찬가지로 DNA polymerase gene과 자체 DNA 복제에 필요한 유전자들을 갖고 있습니다. Viral DNA polymerase는 항바이러스제의 주요 표적으로 작용하며, 현재 CMV 질환에 대한 모든 치료제는 결국 이 viral DNA polymerase를 억제하는 방식으로 작용합니다.
CMV DNA polymerase는 UL54로 명명된 CMV ORF(open reading frame)에 의해 암호화됩니다. 이 단백질은 임상 분리주에서 약 4%의 다형성(polymorphic nucleotide variation)만이 관찰될 정도로 매우 보존되어 있는 특징이 있습니다. UL54는 또한 UL44라는 accessory protein과 함께 작용하여 DNA polymerase의 processivity(연속 반응 능력)를 향상시킵니다. 이 두 단백질은 감염된 세포 내에서 기능적인 완전한 DNA polymerase 복합체를 형성합니다.
CMV genome은 또한 protein phosphotransferase 효소를 암호화하는 UL97 유전자를 포함하고 있습니다. 이 효소는 CMV DNA 복제 과정에서의 정확한 역할은 아직 명확하게 밝혀지지 않았지만, DNA 복제와 관련된 단백질이나 CMV UL144 단백질을 인산화할 수 있으며, 세포 내의 retinoblastoma tumor suppressor를 인산화하여 비활성화시키는 기능도 가지고 있는 것으로 알려져 있습니다.
진단
CMV matrix protein인 pp65에 대한 monoclonal antibody를 이용하여 neutrophil 내 항원을 직접 검출하는 방법은 특히 유용한 것으로 입증되었습니다.
CMV DNA 또는 RNA를 검출하는 다른 방법으로는, 바이러스 핵산 탐침(labeled viral nucleic acid probes)과 체액 또는 조직 검체에서의 nucleic acid hybridization을 사용하는 기법이 있습니다.
Polymerase chain reaction(PCR) assay는 CMV immediate early antigen 또는 CMV DNA polymerase를 암호화하는 유전자에 특이적인 primer를 사용하며, CMV를 검출하는 데 매우 민감한 기술로 자리잡았습니다. PCR assay는 다양한 체액에서 극소량의 CMV DNA도 검출할 수 있습니다.
면역기능이 정상인 사람에서는 IgM 및/또는 낮은 avidity의 IgG 항체 존재가 primary infection의 특징적인 소견입니다. 그러나 면역억제 상태의 환자에서는 항체 반응이 지연되거나 나타나지 않을 수 있으며, 이러한 항체 검사는 주로 후향적(retrospective) 진단에 제한적으로만 활용될 수 있습니다. IgG 항체의 존재는 기증자 및 이식 수혜자의 과거 CMV 감염 노출 여부를 확인하는 데 사용되며, 주로 이식 대기자 등록 시점 또는 장기 적출 시점의 기증자 평가에 이용됩니다. 그러나 이식 후에는 진단적 가치가 제한적입니다.
Plasma, whole blood, 또는 leukocyte를 이용한 PCR 기반의 검사법은 훨씬 더 민감하며, 영국을 포함한 많은 검사실에서 표준 진단법(gold standard)으로 자리 잡고 있습니다. Real-time PCR은 viral load에 대한 높은 재현성을 가지는 데이터를 신속하게 제공할 수 있어 그 활용이 점차 증가하고 있습니다.
치료
CMV에 의한 말기 장기 침범(end-organ disease)의 치료에 효과가 있는 것으로 입증되었으며, 미국에서 사용 승인을 받은 항바이러스제는 세 가지가 있습니다. 이 약제들은 모두 viral DNA polymerase를 억제하는 기전을 가지고 있으며, 각각 GCV, foscarnet, 그리고 cidofovir(CDV)입니다.
(1) Ganciclovir
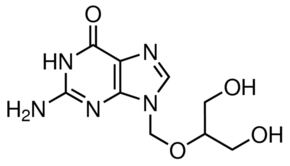
Ganciclovir는 guanosine의 nucleoside analogue로, acyclovir와 구조적으로 유사한 homologue입니다. Ganciclovir는 사람에서 CMV 질환 치료에 효과가 있는 것으로 처음 입증된 항바이러스제입니다.
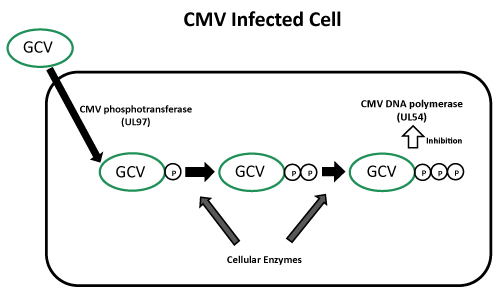
Ganciclovir 의 작용 기전
Ganciclovir 는 CMV 가 감염된 세포에서 UL97 유전자가 만들어 내는 Phosphotransferase 에 의해 Ganciclovir monophosphate 로 전환되고 이 후 세포 효소에 의해 활성형인 Triphosphate 로 전환되어 이것이 바이러스의 DNA 에 결합하여 dGTP 가 결합하는 것을 경쟁적으로 저해함으로써 효과를 나타낸다. 따라서 DNA 복제를 억제함으로써 바이러스 합성을 억제한다. Ganciclovir triphosphate 의 세포내 농도는 Acyclovir 보다 CMV 에 감염된 세포에서 10배 이상 높고, Acyclovir 의 반감기인 1~2시간보다 16.5~24시간으로 훨씬 길기 때문에 CMV infection 에 대해 Ganciclovir 가 효과적이다.
Ganciclovir 에 대한 내성 기전
Ganciclovir 의 인산화에 관여하는 UL97 유전자와 DNA polymerase 유전자인 UL54 의 point mutation 또는 Deletion 에 의해 발생하며, UL97 유전자의 돌연변이가 더 흔하다. (Ganciclovir 에 대한 IC50, inhibitory concentration 이 10 uM 이상의 고도 내성인 경우 (보통 1.5~3 ug/mL 이상일 때를 내성으로 보고), cidofovir 에 교차내성을 보이나, Foscarnet 에는 감수성을 보임.)
Ganciclorvir 내성 발생의 risk factors
- (1) 장기간 Ganciclovir 사용
- (2) CMV 초감염
- (3) ATG 를 포함한 강도 높은 면역억제제의 사용 등
내성검사는 시행이 어려울 뿐 아니라 시험관 내에서 시행한 내성 검사 결과와 약물 치료에 대한 임상적 반응이 반드시 일치하는 것은 아니어서 일반적으로 시행되지는 않는다.
내성을 의심하여 검사를 고려해야 하는 경우
(1) AIDS 환자, 특히 CD4+ 세포수가 50/uL 미만으로 3~4개월 이상 장기간 ganciclovir 치료를 하는 경우
(2) CMV 항체 양성인 공여자로부터 장기 이식을 받은 CMV 음성 수여자에서 장기간 예방적 Ganciclovir 투여시
–> 최대 용량의 항바이러스제를 주사함에도 불구하고 DNAemia 혹은 antigenemia, viremia 가 지속되거나 증가할 때
(3) 조혈모세포 이식 환자에서 CMV 감염에 대해 Ganciclovir 선제 치료를 3주간 시행하였는데, antigenemia 가 계속 증가하거나, 4주간 투여 후에도 음전되지 않고 지속되는 경우
–> 조혈모세포 이식환자에서 ganciclovir 선제치료 2주 후에도 CMV antigenemia 가 계속 증가한다면 ganciclovir 내성보다는 숙주의 면역학적 요인이나 다른 이식 관련 요인들을 먼저 생각해보아야 한다.
내성이 의심될 경우 표현형 검사 (Plaque reduction assay) 와 유전형 검사를 동시에 시행하는 것이 도움이 된다.
Gancyclovir 의 부작용
골수 억제가 가장 중요한 부작용이며, 용량과 연관되어 있다. (호중구 감소, 혈소판 감소 등)
두통, 어지러움, 정신착란, 환시, 정신병, 떨림, 경련, 운동실조, 졸림, 혼수 등이 환자의 5~15% 정도에서 보고됨. 빈혈, 발진, 발열, 간기능장애, 오심, 구토, 호산구 증가 등도 보고됨. 임신 category C 이며, 동물 실험에서 기형 발생등 가능성 있으므로, 임신이나 수유 중에는 사용하지 않는다.
(2) Valganciclovir
Valganciclovir(VGC)는 GCV의 발린 에스터(Valine ester) 형태로, GCV에 비해 경구 생체이용률이 훨씬 높습니다. 경구 투여 시 약 68%가 흡수되는 반면, 경구 GCV는 6~8% 정도만 흡수됩니다. 인체 장 점막에 존재하는 발린 에스테라아제(valine esterase)가 발린 에스터를 분해하면 GCV가 혈류로 들어가게 됩니다. 경구로 450mg 정제 두 알을 복용하면, 체중 1kg당 5mg씩 정맥 주사하는 GCV와 동등한 혈중 농도를 유지할 수 있습니다.
(3) Foscarnet
Foscarnet은 pyrophosphate 유사체로, CMV 및 다른 herpesvirus의 DNA polymerase에 직접 결합하는 가역적 경쟁 억제제입니다. 이 약물은 바이러스 DNA의 신장 과정에 직접 포함되지 않습니다. Foscarnet 치료는 신독성(nephrotoxicity)과 대사 독성(metabolic toxicity)과 관련이 있으며, 신부전, 저칼슘혈증(hypocalcemia), 저마그네슘혈증(hypomagnesemia), 저인산혈증(hypophosphatemia)과 같은 심각한 부작용을 일으킬 수 있습니다. 그러나 이러한 부작용은 혈청 크레아티닌 수치를 면밀히 모니터링하고, 약물 용량을 조절하며, 마그네슘, 칼슘, 인의 결핍을 경구 보충제로 보충함으로써 효과적으로 관리할 수 있습니다.
(4) Cidofovir
Cidofovir([S]-1[3-hydroxy-2(phosphorylmethoxy)propyl] cytokine)는 cytosine의 nucleotide analogue로서, in vitro에서 CMV에 대해 강력한 항바이러스 활성을 보입니다.
Cidofovir는 phosphonate 그룹을 포함하고 있어 바이러스 효소에 의해 인산화될 필요가 없습니다. 따라서 thymidine kinase가 결핍된 herpes simplex virus와 UL97 유전자의 변이가 GCV에 대한 내성을 부여하는 cytomegalovirus에 대해서도 효과적입니다.
Cidofovir는 세포 내 효소에 의해 CDV triphosphate로 전환되며, 이 형태가 바이러스 DNA polymerase를 억제하는 활성 물질입니다. CDV triphosphate는 세포 내 반감기가 길어 주 1회 투여만으로 충분합니다. 최대 허용 용량은 주 5 mg/kg의 정맥 주사이며, 이 용량은 유도(induction) 단계에서 2주간 매주 투여한 후, 이후부터는 2주마다 1회 투여합니다.
CDV 투여 시에는 매번 정맥 주사 전에 경구로 probenecid 2g을 함께 투여해야 합니다. CDV의 주요 독성은 신장의 근위 곱슬 세뇨관 세포(proximal convoluted renal tubular cells)가 CDV를 흡수하면서 세포 변성 및 괴사가 발생하는 데서 비롯되며, 이 손상은 회복 불가능할 수 있습니다. Probenecid는 CDV의 신장 세포 흡수를 차단하여 신장 세포가 손상받는 것을 방지합니다.
Gancyclovir 내성 CMV 감염
내성 검사를 하지 못하는 경우라면 Foscarnet 투여 권장.
UL97 과 UL54 에 모두 돌연변이가 있는 경우라면 ganciclovir 와 cidofovir 에 교차내성을 보이나, UL97 부위에만 돌연변이가 있을 경우 Cidofovir 도 시도해 볼 수 있다. (Ganciclovir 에 대한 IC50, inhibitory concentration 이 10 uM 이상의 고도 내성인 경우 (보통 1.5~3 ug/mL 이상일 때를 내성으로 보고), cidofovir 에 교차내성을 보이나, Foscarnet 에는 감수성을 보임.)
임상에서 분리된 CMV가 GCV에 대해 높은 내성(IC50 ≥ 30 μmol/L)을 보이고 UL97 유전자와 DNA polymerase 유전자 모두에 돌연변이가 있는 경우, CDV에 대해서도 교차 내성(cross-resistance)이 관찰될 수 있습니다. 그러나 이러한 분리주는 여전히 foscarnet에 대해서는 감수성을 유지합니다.
신이식 환자의 CMV 감염
혈청양성 공여자로부터 혈청음성 환자에게 이식한 경우 CMV 감염의 빈도는 70~90%, CMV 질환의 빈도는 50~60% 로 높다.
신장 이식의 약 8%, 간 이식의 29%, 심장 이식의 25%, 그리고 폐 이식의 39%에서 증상이 있는 CMV 감염이 발생할 수 있습니다. Snydman 등은 Anti-Lymphocyte Globulin을 투여받은 혈청 음성 수혜자(seronegative recipients)가 혈청 양성 신장 기증자(seropositive kidneys)로부터 이식받았을 때 사망률이 30%에 이른다는 결과를 보고하였습니다. 반면, 혈청 양성 수혜자가 혈청 양성 기증자(D+/R+) 또는 혈청 음성 기증자(D-/R+)로부터 이식받은 경우에는 질병 발생 빈도가 매우 낮았습니다.
CMV는 여러 인간 변종(strain)이 존재하기 때문에, 혈청 양성 장기 수혜자는 다른 바이러스 변종에 의한 재감염 위험이 있습니다. 이 경우 임상 증후군은 일반적으로 일차 감염(primary infection)보다 덜 심하며, 증상 발현 시점이 이식 후 약 68주로 지연되는 경향이 있습니다. 또한 혈청 양성 수혜자가 혈청 음성 이식편(및 혈청 음성 혈액 제제)을 받은 경우에도 잠복 바이러스가 재활성화되어 CMV 질환이 발생할 수 있습니다. 이 경우도 일반적으로 일차 감염보다는 경미한 증상을 보이며, 증상 발현이 68주 후로 지연되는 경우가 많습니다.
한 연구에서는 신장 이식 환자군에서 바이러스 부하(viral load)에 따른 CMV 질환 발생 확률을 그래프로 나타냈는데, 바이러스 부하가 5 log10 copies/ml일 때 발생 확률이 20%, 5.5 log10 copies에서는 50%, 6 log10 copies에서는 약 80%에 달하는 것으로 나타났습니다.
CMV로 인한 이환율(morbidity)은 신장 이식 환자에서 가장 낮은 편이나, 혈청 양성 기증자로부터 혈청 음성 수혜자(D+/R-)에게 일차 감염이 발생할 수 있으며, 이 경우 2차 감염보다 증상이 훨씬 심한 경향이 있습니다.
두 연구에서 총 154명의 신장 이식 환자에서 CMV 감염의 임상 및 실험실 소견이 보고되었습니다. 한 연구에서는 18명의 일차 감염 환자 중 13명이 발열, 백혈구 감소증, 비정형 림프구, 림프구증가증, 간비종대, 근육통, 관절통 중 최소 두 가지 이상의 증상을 동반하였으며, 이러한 증상 조합을 CMV 증후군(CMV syndrome)이라 명명하였습니다. CMV 증후군은 48시간 이상 원인 불명의 발열, 권태감, 그리고 3일 연속 지속되는 호중구 감소를 특징으로 합니다. 신장 이식 환자에서 가장 흔한 CMV 관련 질환 양상이며, 이는 2차 감염 시 나타나는 임상 증상과 대조적입니다. 2차 감염 환자의 경우 발열이 동반되는 경우가 19%에 불과합니다.
임상적으로 의미 있는 CMV 간염은 신장 이식 환자에서 드물게 발생하지만, 일차 감염 환자 16명 중 10명(63%)에서 간 효소(aspartate aminotransferase) 상승이 관찰되었습니다. 같은 그룹에서 CMV 간질성 폐렴이 5건 확인되었고, 일차 감염 환자 16명 중 4명에서는 이식 신장 거부 반응이 나타났습니다. 한편, 혈청 음성 기증자와 혈청 음성 수혜자(D-/R-) 쌍에서 24명의 환자가 혈청 음성 상태를 유지했으며, 이들은 거부 반응을 경험하지 않았습니다. 이 연구는 CMV 감염이 이식 장기 거부 반응 가능성을 높일 수 있다는 결론을 제시한 드문 연구 중 하나입니다.
또 다른 대규모 연구에서는 126명의 신장 이식 환자 중 22%에서 간 기능 장애가 관찰되었고, 이 중 7명에게서 중증 간염이 나타났으며, 이들 모두에서 체액에서 CMV가 분리되었습니다. 부검 결과 5명은 간에서 CMV 감염 증거가 확인되었습니다.
소규모 연구에서 CMV 폐렴이 발생한 신장 이식 환자의 사망률은 48%로 보고되었는데, 이는 골수 이식 환자에서 보고된 최대 84%의 사망률보다 낮은 수치입니다. 신장 이식 환자에서 CMV 폐렴이 발생할 경우, GCV 단독 치료가 중증 간질성 폐렴에 효과적임이 확인되었습니다.
신장 이식 환자에서 CMV 질환 예방을 위한 연구도 활발히 진행되었습니다. 한 연구에서는 혈청 음성 신장 이식 환자 24명에게 이식 72시간 이내에 고면역 글로불린(hyperimmune globulin)을 투여하고 16주간 지속하였으며, CMV 감염률은 71%로 대조군 35명(77%)과 비슷했지만 증상성 질환 발생률은 60%에서 21%로 감소하였습니다. 치료군에서 CMV로 인한 사망자는 1명, 대조군에서는 5명이었으며, 높은 CMV 질환 및 사망률은 항림프구 글로불린(antithymocyte globulin)의 광범위한 사용과 관련이 있을 수 있습니다. 그러나 고면역 글로불린을 이용한 예방은 간 이식 등 다른 고형 장기 이식 후 일차 CMV 질환 예방에는 효과가 없는 것으로 나타났습니다.
혈청 양성 신장 이식 환자에서 CMV 항원 검출은 GCV를 이용한 선제 치료(preemptive therapy) 시작 시점에서 사용되어 CMV 질환 예방에 성공을 거두었습니다. 또한 경구용 GCV 치료도 신장 이식 후 CMV DNA 수치를 낮추고 CMV 질환을 예방하는 데 효과적이었습니다.
Reference :
The AST Infectious Diseases Community of Practice.
The American Society of Transplantation Infectious Disease Guidelines 3rd Edition. Am J Transplant 2013;13